12月11日,中国国家药品监督管理局药品审评中心(CDE)官网最新公示,永泰生物-B(06978.HK)研发的抗CD19单链抗体嵌合抗原受体T细胞注射液(以下简称CAR-T-19细胞注射液)成功被CDE纳入突破性治疗品种名单,适应症为25岁(含)以下复发/难治B细胞急性淋巴细胞白血病。
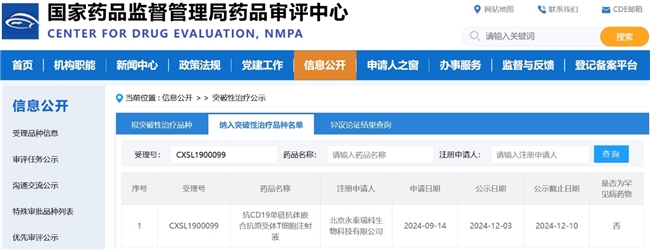
图 CDE网站截图(纳入突破性治疗品种名单)
复发/难治B细胞急性淋巴细胞白血病是严重危及儿童及青少年生命健康的血液恶性肿瘤,是我国儿童肿瘤的主要死亡原因之一。常规化疗、新的靶向治疗、免疫治疗等药物被临床应用,但均未有效改变治疗困境,因此我国儿童复发或难治B细胞急性淋巴细胞白血病患者目前存在非常迫切的临床需求,需要探索更为安全有效的治疗手段。
永泰生物公司自主研发的CAR-T-19细胞注射液,于2020年12月25日获得CDE《药物临床试验批准通知书》,2023年第三季度完成注册I期剂量探索性试验;2023年底启动II期确证性临床试验,截至2024年12月,临床试验进展顺利,现有数据表明整体安全性良好,风险可控。与FDA批准的诺华制药生产的同类产品Kymriah在安全性、有效性等数据相当,有望解决我国该类患者的临床用药急需。
本产品适应症为25岁(含)以下复发/难治B细胞急性淋巴细胞白血病,符合《突破性治疗药物审评工作程序(试行)》中“与现有治疗手段相比有足够证据表明具有明显临床优势的创新药”的要求。主要的优势有以下几点:
临床需求迫切
目前全球只有Kymriah获批用于治疗儿童及青少年复发/难治B细胞急性淋巴细胞白血病(25岁及以下),国内尚无针对治疗儿童及青少年该适应症的CAR-T产品上市。本产品获批上市后,可解决我国该类患者的临床用药急需。
具有自主知识产权,技术自主可控、产品可及性好
永泰生物CAR-T-19细胞注射液,CAR结构为经典的2代CD19 CAR,安全性与有效性已被广泛认可;永泰生物具备符合GMP体系的质粒和慢病毒载体生产技术平台和质量检验平台,生产的第三代慢病毒载体基因修饰系统,技术水平和生产工艺处于国内领先水平。自主可控且成本相对较低,上市后药品可及性更好
国内专业实力领先临床研究团队
永泰CAR-T-19细胞注射液的II期临床研究由国内顶尖的医学临床专家团队负责试验设计和实施。由我国最大的集医疗、科研、教学、产业于一体的国家级科研型血液病专业机构——中国医学科学院血液病医院作为牵头单位,北京大学人民医院等全国多家临床中心参与,为本试验科学严谨高效开展提供了有力保障。
本次永泰生物CAR-T-19细胞注射液被纳入突破性治疗品种名单,意味着永泰生物在血液肿瘤治疗领域取得了可喜的进展,产品上市后可惠及更多的罹患B细胞急性淋巴细胞白血病的儿童和青少年患者,为他们带来更多治愈的可能与希望。