北京时间2023年11月23日,国际感染病学期刊排名第一的《柳叶刀-感染病学》(The Lancet Infectious Diseases,影响因子:56.3)发布了国产新冠口服药民得维®(氢溴酸氘瑞米德韦片,产品代号:VV116/JT001)的一项Ⅲ期临床研究的完整数据。据了解,这是首个在国际顶级医学期刊发表的国产新冠口服药Ⅲ期注册临床研究结果,也是继2022年底民得维®实现首个中国自主研发的新冠创新药临床试验数据首登国际顶级医学期刊《新英格兰医学杂志》(NEJM,影响因子:158.5)之后,第二项获得国际学术界认可的Ⅲ期临床研究。基于该研究,民得维®已于今年1月在中国获批用于治疗轻、中度COVID-19成年患者。

来源:The Lancet Infectious Diseases官网
本次发表基于一项多中心、随机、双盲、安慰剂对照、Ⅲ期临床研究(NCT05582629),由浙江大学传染病诊治国家重点实验室主任李兰娟院士牵头,在全国31家中心开展。李兰娟院士为论文的通讯作者,上海市公共卫生临床中心范小红教授和凌云教授,浙江树人大学树兰国际医学院附属树兰(杭州)医院戴霞红教授、吴丽花教授和汤灵玲教授作为共同第一作者。
该研究在期中分析阶段即已获得具有统计学意义和临床意义的显著结果,与安慰剂相比,民得维®治疗轻、中度新冠病毒感染成人患者(≥18岁)可显著缩短咳嗽、流涕、发热、腹泻等11项临床症状的消失时间,中位时间比安慰剂组缩短2天(HR=1.21,P=0.0023)。最终分析结果与期中分析一致,症状消失中位时间比安慰剂组缩短2天(HR=1.17,P=0.0009),为国内外新冠口服药已报道数据中表现最优,进一步证明了民得维®的疗效获益。60岁以上老年患者的亚组分析数据与整体人群一致。
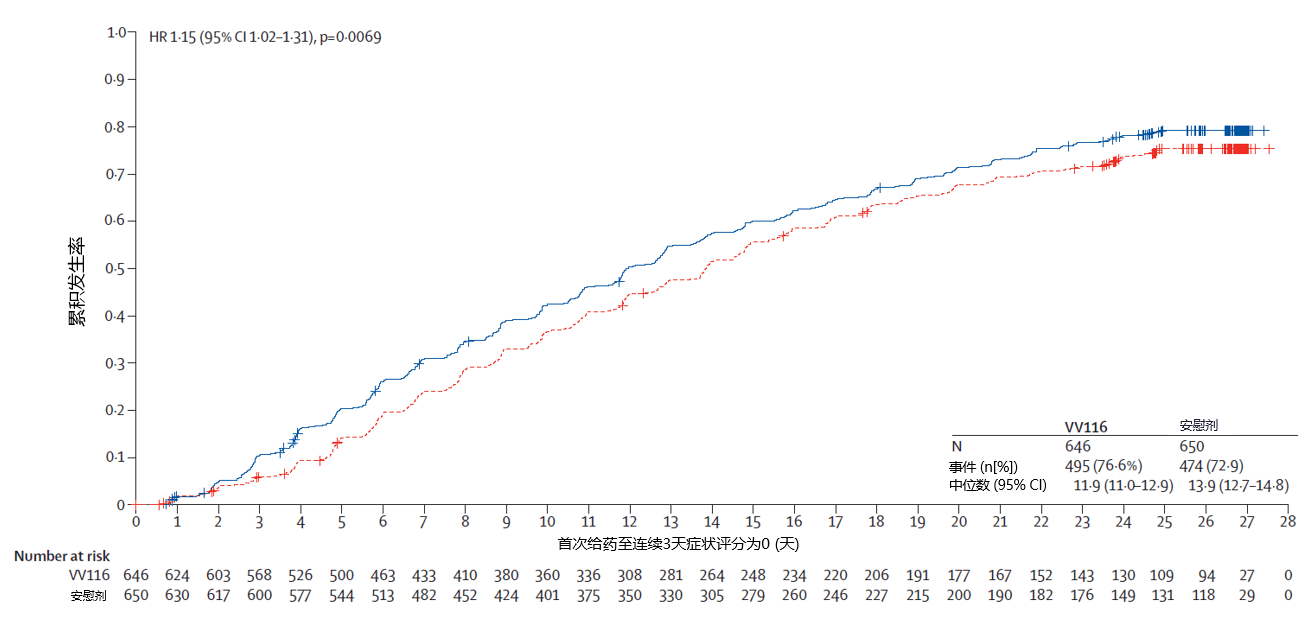
至持续2天临床症状消失时间
此外,截至给药第5天,接受民得维®治疗的患者病毒转阴比例明显高于安慰剂组(41.6% vs 31.1%,P<0.0001),民得维®组的病毒Ct值上升速度以及病毒载量下降速度也较安慰剂组更快。值得注意的是,研究结果表明,无论患者是否伴有进展为重症的高风险因素,或是否接种过新冠疫苗,均可实现明显获益。研究期间,安慰剂组有1例患者进展为重症,而民得维®组没有患者进展为重症,两组均未出现死亡。民得维®在各人群中(包括老年患者)的安全性良好,不良事件(AE)发生率与安慰剂相似。
本次试验的研究对象同时纳入了普通人群和伴有进展为重症的高风险因素人群,也覆盖了不同的奥密克戎变异株,能够更加全面、客观地体现民得维®在现实场景中的临床应用价值。在纳入主分析集的1296例(民得维®组646例,安慰剂组650例)患者中,中位年龄为35.0岁,有558例(43.1%)患者伴有高风险因素。研究入组期间进行的病毒遗传变异检测结果显示,患者感染的奥密克戎变异株以BA.5.2.48和BF.7.14为主要变体亚型。
综合此前《新英格兰医学杂志》发表的民得维®“头对头”对比3CL抑制剂“P药”(奈玛特韦片/利托那韦片组合包装)的Ⅲ期临床研究(NCT05341609)成果,民得维®具有非常明确的抗病毒效果,能够有效治疗伴或不伴有进展为重症的高风险因素的轻、中度COVID-19成人患者,可显著加速症状缓解和消失、缩短病程,且相较P药的适用人群更广,尤其是对于因患有合并症需要服用多种药物的患者,民得维®的药物相互作用更少。
君实生物全球研发总裁邹建军博士表示:“迄今为止,包括多项国内外大型Ⅲ期研究在内,全球已有超过3000例患者参与民得维®的研究,为民得维®在更广泛人群中的应用提供了扎实的数据支持,也让该药物成为目前循证证据最充分的国产新冠口服药之一。一年内两次登上国际顶级医学期刊,是对民得维®研究团队的科研水平、研发质量的高度认可,我们对此感到非常自豪。国产新冠创新药的崛起,是我国医药产业创新发展成果的重要体现之一,是对保障人民群众生命安全和身体健康的有力践行。君实生物将携手各方继续前行,助力产业发展、造福更多患者!”
【参考文献】
1. Xiaohong Fan, Xiahong Dai, Yun Ling, et al. Oral VV116 versus placebo in patients with mild-to-moderate COVID-19 in China: a multicentre, double-blind, phase 3, randomised controlled study. The Lancet Infectious Diseases. DOI:10.1016/S1473-3099(23)00577-7.
关于民得维®(氢溴酸氘瑞米德韦片,VV116/JT001)
VV116是一款口服核苷类药物,可抑制SARS-CoV-2复制。临床前药效学研究显示,VV116在体外对包括奥密克戎在内的新冠病毒原始株和突变株表现出显著的抗病毒作用;在小鼠模型上,低剂量的VV116就可将肺部病毒滴度降低至检测限以下,可显著改善肺组织病理变化,表现出较强的抗病毒功效。临床前的药代动力学等研究结果显示,VV116具有很高的口服生物利用度,其口服吸收后,迅速代谢为母体核苷,并在体内组织广泛分布。
VV116由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、中国科学院中亚药物研发中心/中乌医药科技城(科技部“一带一路”联合实验室)、临港实验室、苏州旺山旺水生物医药有限公司(旺山旺水)和君实生物共同研发。
在新冠疫情期间,VV116开展了多项国际多中心临床试验。 1项在伴有进展为重症高风险因素的轻中度COVID-19患者中对比PAXLOVID用于轻中度COVID-19早期治疗的Ⅲ期临床研究(JT001-010)获得国际权威期刊《新英格兰医学杂志》(The New England Journal of Medicine)发表[1],另1项在伴或不伴有进展为重症高风险因素的轻中度COVID-19患者中开展的Ⅲ期临床研究(JT001-015)获得国际顶尖感染病学期刊《柳叶刀-感染病学》(The Lancet Infectious Diseases)发表[2]。
2021年12月,VV116在乌兹别克斯坦获得批准用于治疗中/重度COVID-19患者。
2023年1月,VV116在中国获得批准用于治疗轻中度COVID-19的成年患者。